課題11「DNAによる生物の識別」と,課題13「生体高分子の形とはたらき」では,分子生物学の実験に用いられる基本的な器具類を取り扱うことになる.ここでは,それらの使用法について解説する.
器具の名称と使用方法
マイクロチューブ
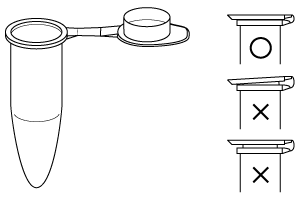
図1.マイクロチューブ.右はフタの閉め方についての注意.
分子生物学実験においては,多くの場合,扱う溶液の量はマイクロリットル単位であるため,化学実験で一般的に用いられているガラス製の 18 mm 径の試験管(test tube)よりも小さい容器が必要とされる.さらに,実験の効率化とコンタミネーション防止のために,使い捨てで使用する合成樹脂製のマイクロチューブ(micro tube)が使われる.最初に発売したメーカー名をとって,エッペンドルフチューブ(国内ではさらには略してエッペン) と呼ぶこともある (書類を綴じるステープラをホッチキスと呼ぶようなものか).この実験では,1.5 mL,0.6 mL 容量のものを用いる(研究室では 0.2 mL のものも用いられている).PCR のために側面の壁を薄く仕上げた(熱が伝わりやすい)PCR チューブ,容量目盛りのついたストックチューブなどの種類がある.自立しないのでチューブラックに立てて置く.ラックはチューブの径に応じた2種の口径のものがある.フタの裏側は,試料溶液と直接触れ合う部分なので,指で触らないように注意する(触ると試料を汚染してしまう可能性がある).
マイクロピペット
マイクロピペットはマイクロリットル単位の溶液を定量,分注するための器具である.各社からさまざまなタイプのものが出ているが,基本的操作は共通している.
使用上の一般的注意
- チップはそれぞれの溶液に専用のものを使う.混合液にはチップを浸さないようにして,液体同士のコンタミネーションを防ぐ.
- チップに溶液が入った状態でマイクロピペット本体を横にしたり,ましてや逆さになどしないこと.ノズル内に溶液が入ってしまう.ノズル内汚染は分解掃除が必要となる.
- 吸入の際にはチップの先端が見えるような位置で行う方が良い.チップ先端が見えていないと,チップが液面から離れて空気を吸い込んで正しい液量が取れない,さらにはピペットノズル内部を汚染してしまう可能性がある.他人の持っているチューブから液を取ることは避ける.
操作方法

図2.マイクロピペット.A.各部の名称.B.上から順に,プッシュボタンのロック,カウンター,プッシュボタン位置
- ロックハンドルを解除の方向に回し,ロックを解除する.
- プッシュボタンを回し,デジタルカウンタを希望の容量にあわせる.このとき容量を減らす方向にボタンを回すと正確に合わせることができる.従って,容量を増やしたいときにはいったん希望容量を超えるまでボタンを回してから減らすようにして合わせる.
- ロックハンドルをロックする.これを忘れると容量が不正確となる.
- ピペットチップをノズル先端にはめる.チップには手を触れてはならない.チップのささったラックから直接装着する.
- プッシュボタンを図2B の b の位置まで押し込んだ状態で吸引したい溶液にチップ先端を浸す.
- プッシュボタンを静かに図2B の a の位置まで戻して溶液を吸引する.このとき指をボタンから絶対に離してはならない.さもないとチップ内で溶液が踊ったり,噴水になったりして容量が正しくなくなるうえ,ノズルを汚染することにもなる.
- 溶液を移すべき容器内側の壁にチップ先端をつけ,プッシュボタンを図2B の b の位置まで静かに押し込む.一拍おいてからボタンを図2B の c の位置まで強く押し込む.チップ先端を壁につけることを忘れてはならない.そうしないと正しく溶液が排出されず,容量は不正確となる.
- 使い終わったチップは廃棄用容器の上でエジェクタボタンを押してはずす.
動画教材:マイクロピペットの使い方
小型微量遠心機
マイクロチューブ中の溶液を撹拌した後に,溶液を底に集めるために用いる.スピンダウンと呼ばれる操作である.
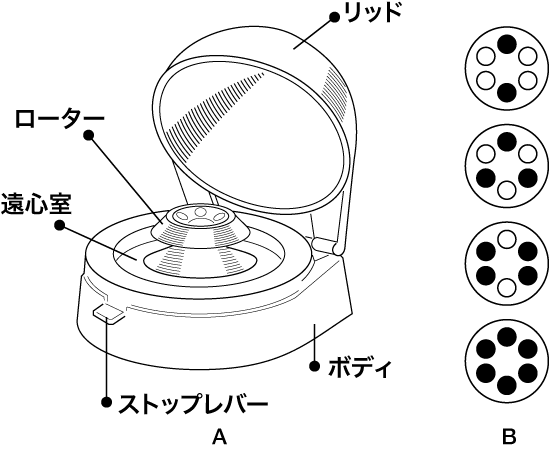
図3.小型微量遠心機.A.各部の名称.B.チューブのセット位置.必ず回転対称となるようにチューブをセットする.
操作方法
- 試料チューブを回転軸に対して対称になるようにセットする(図3B 参照).試料チューブが 1 本または 5 本の場合は,水を入れたチューブでバランスを取る(一般的には,比重の等しい溶液でバランスを取るべきである.ここでは,比較的希薄な溶液であり,比重が 1 に近いこと,また絶対的重量が小さいことから,水でよいことにする).各チューブの液量が大きく異なるとバランスされないので注意.
- 本体背面の電源スイッチがonになっていることを確認し,リッドを閉めると遠心が開始される.
- ストップレバーを押し下げると,ローターにブレーキがかかり,リッドのロックが解除される.ローターが停止するのを待ってリッドを開け,試料を取り出す.
電気泳動装置
DNA の分離分析のために行う電気泳動は,一般にサブマリン型電気泳動装置と呼ばれる装置で行う.この実験では Mupid(ミューピッド)という製品を使用する.泳動装置は,泳動槽,ゲルメーカー板,本体ふた,定電圧電源装置からなる.

図4.サブマリン型電気泳動装置
実験操作
- 緩衝液の注入とゲルのセット
泳動槽内に緩衝液指標線まで緩衝液を満たす(約300 mL).ゲルをゲルメーカー板ごとセットする.泳動開始側(サンプル・ウェルのある側)が電源装置に近くなるようにセットする.ゲルはゲルメーカー板の耳を持って扱い,ゲルに直接触れてはいけない. - 試料のアプライ
試料をゲルに注入することを「試料をアプライ(apply)する」という.試料には,泳動用色素を加え(泳動状況を可視化するとともに,試料の比重を上げてアプライを容易にするためである),適量をゲルのウェル(サンプルの入る穴/凹み)に注入する.試料をウェルの外に大量にこぼしたり(少量であれば問題ない),ゲルにチップを突き刺したりしないように,落ち着いて慎重に操作すること.ピペットノズルの先端付近に手を添えて安定させると良い(ただしチップ自体には触れないようにする).
ウェル内に入れられた試料溶液はその瞬間からゲル内に拡散していく.したがって試料のアプライは間を置かず次々と手際よく行い,なるべく早く泳動を開始したほうが良い.アプライの順番などをあらかじめ良く計画して,準備を整えた上で作業にかかること. - 泳動の開始
定電圧電源装置を泳動装置に差し込んでからコンセントへつなぐ.泳動槽のふたを閉めると,安全スイッチが入り,通電可能となる.電圧切り替えスイッチが 100 V にセットされていることを確認して電源スイッチを入れると泳動が開始される.開始後数分経ったら,正しい方向に泳動されているか確認する. - 泳動の終了
泳動開始から 25~30 分経って,色素の移動度を目安に泳動を終了する(TA に確認してもらうこと).ふたを開けると安全スイッチが切れて通電は止まる.電源スイッチを off にしてから電源装置を外す.
ゲルをゲルメーカー板ごとはずして,TA の指示にしたがってエチジウムブロマイド染色を行う.

図5.ゲルへの試料のアプライの仕方.実際にはゲルは泳動槽の中にセットされており,緩衝液の中に沈んでいる.左図:ピペットの先端に手を添えて安定させる.右図:ウェルの長辺に沿ってピペットを向けた方がアプライしやすい.
実験技術
コンタミネーションの防止
コンタミネーション(contamination)とは,試料の汚染,特に意図しない物質が混入することによる汚染をいう.もともとは,放射性物質の混入による汚染や,微生物の混入による細菌汚染の際に用いられていた用語だが,今日では一般の物質,溶液の意図しない混入にも用いる.
実験では多くの種類の溶液を混合して反応液を製成するが,この際に不必要な物質が混入すれば反応がうまく進まなかったり,分析結果が正しくなくなる可能性がある.また保存試薬液(ストック液;stock solution という)にコンタミネーションが起こると,以降の実験に用いることができなくなる.このため,分子生物学実験では使い捨て(disposable)の器具を多く用いてコンタミネーションを防止している.しかし,いくら器具を使い捨てにしても,使用する者が正しく扱わなければ意味はない.試薬の混合の際には,混ぜるべきもの,混ぜてはいけないものを良く考えて操作する必要がある.
撹拌
この実験で扱う試薬には,成分保護などのためにグリセロール(グリセリン)を含むものがある.これらの試薬は比重が大きいため底に溜まり容易には拡散しない.そこで,溶液を確実に撹拌する必要がある.一方,酵素溶液のようなタンパク質を含む溶液を撹拌する際には,できるだけ泡を立てないようにしなくてはならない.これは,酵素タンパク質が気泡によって変性し,失活することを防ぐためである.
ピペッティング(pippeting)は溶液をピペットで吸入,吐出することを何回か繰り返す方法で,最も穏やかにかつ確実に撹拌できる方法である.しかし初心者が行うと吸入時にピペットチップ内で溶液が踊って,ピペットのノズル内部を汚染したり,溶液を失うことになりがちであるため,この実験では原則的には用いない.
チューブの下の方を指先で叩いたり弾いたりして撹拌する方法をタッピング(tapping)という.溶液の量が少ない場合には効率的な方法である.チューブを何回か逆さにして混ぜる方法もある(転倒混和 upside down).溶液の量が比較的多い場合にはこの方法が良い.いずれの場合も,チューブのふたをしっかり閉めていないと溶液を失うことになる.また.あまりに激しく振れば,泡が立ち,酵素活性を失うことになる.(ただし,この実験の酵素溶液には界面活性剤が含まれるため,温和に撹拌しても多少の泡立ちは避けられない.確実に撹拌することを重視せよ.)
